Selama reaksi PCR, beberapa faktor pengganggu sering ditemui.
Karena sensitivitas PCR yang sangat tinggi, kontaminasi dianggap sebagai salah satu faktor terpenting yang memengaruhi hasil PCR dan dapat menghasilkan hasil positif palsu.
Yang tak kalah penting adalah berbagai sumber yang menyebabkan hasil negatif palsu. Jika satu atau lebih bagian penting dari campuran PCR atau reaksi amplifikasi itu sendiri terhambat atau terganggu, uji diagnostik dapat terhambat. Hal ini dapat menyebabkan penurunan efisiensi dan bahkan hasil negatif palsu.
Selain inhibisi, hilangnya integritas asam nukleat target dapat terjadi akibat kondisi pengiriman dan/atau penyimpanan sebelum persiapan sampel. Khususnya, suhu tinggi atau penyimpanan yang tidak memadai dapat menyebabkan kerusakan sel dan asam nukleat. Fiksasi sel dan jaringan serta penanaman parafin merupakan penyebab umum fragmentasi DNA dan masalah yang terus berlanjut (lihat Gambar 1 dan 2). Dalam kasus ini, isolasi dan pemurnian yang optimal sekalipun tidak akan membantu.
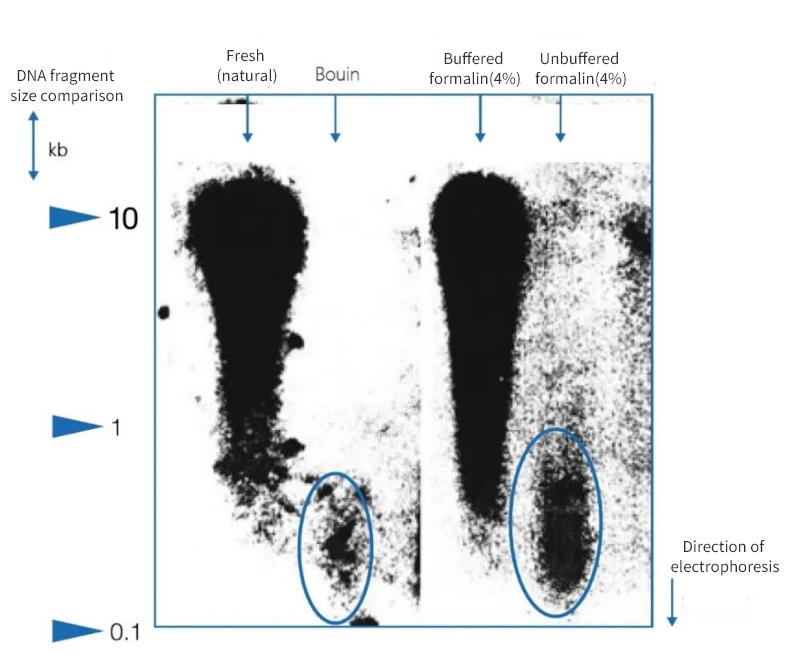
Gambar 1 | Pengaruh imobilisasi terhadap integritas DNA
Elektroforesis gel agarosa menunjukkan bahwa kualitas DNA yang diisolasi dari irisan parafin otopsi sangat bervariasi. DNA dengan panjang fragmen rata-rata yang berbeda terdapat dalam ekstrak, tergantung pada metode fiksasi. DNA hanya terawetkan ketika difiksasi dalam sampel beku asli dan dalam formalin netral berbuffer. Penggunaan fiksatif Bouin yang sangat asam atau formalin tanpa buffer yang mengandung asam format mengakibatkan hilangnya DNA secara signifikan. Fraksi yang tersisa sangat terfragmentasi.
Di sebelah kiri, panjang fragmen dinyatakan dalam pasangan kilobase (kbp)
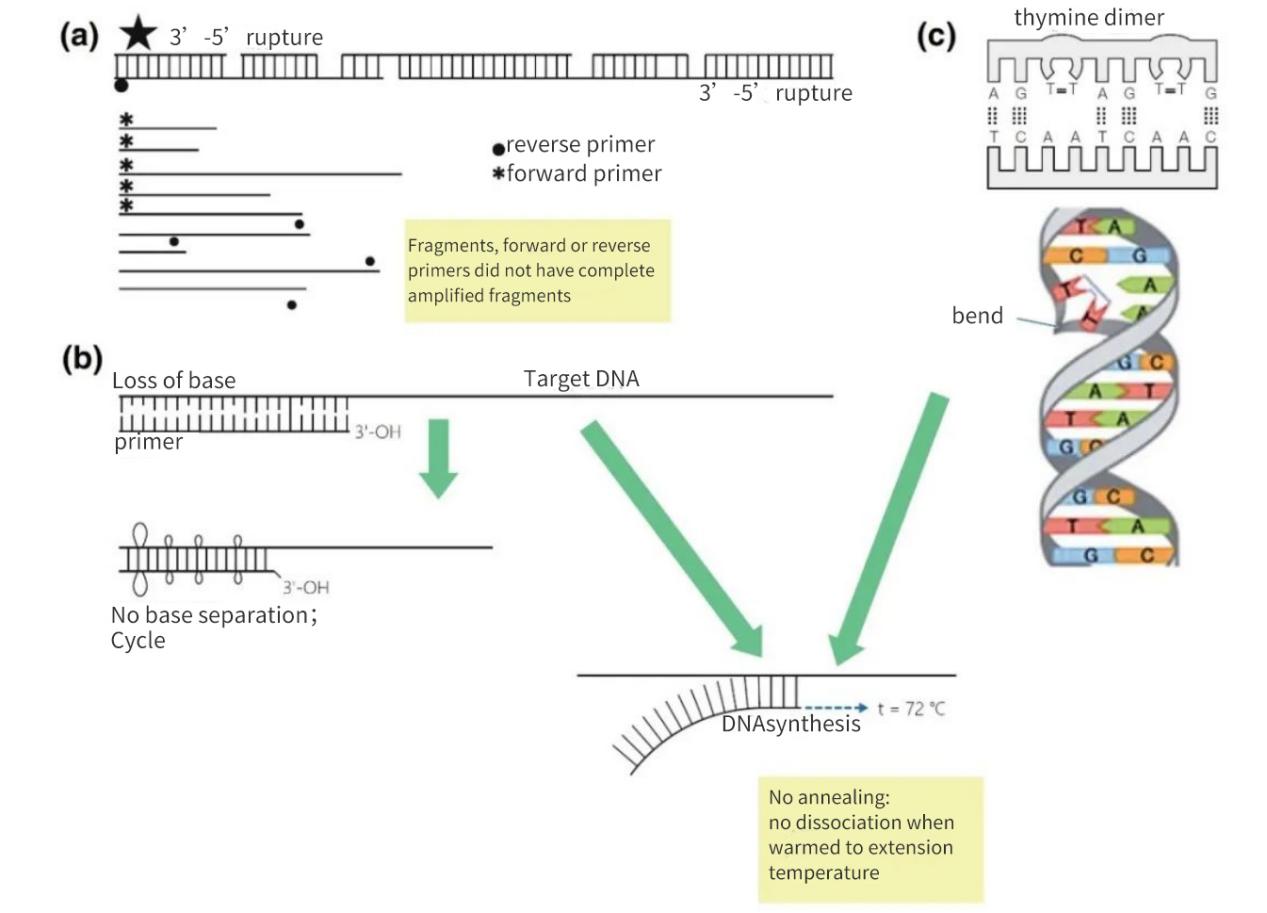
Gambar 2 | Hilangnya integritas target asam nukleat
(a) Celah 3′-5′ pada kedua untai akan mengakibatkan putusnya DNA target. Sintesis DNA akan tetap terjadi pada fragmen kecil tersebut. Namun, jika situs penempelan primer tidak ada pada fragmen DNA, hanya amplifikasi linear yang terjadi. Dalam kasus yang paling menguntungkan, fragmen-fragmen tersebut dapat saling jenuh kembali, tetapi hasilnya akan kecil dan di bawah tingkat deteksi.
(b) Hilangnya basa, terutama akibat depurinasi dan pembentukan dimer timidin, menyebabkan penurunan jumlah ikatan-H dan penurunan Tm. Selama fase pemanasan yang memanjang, primer akan meleleh dari DNA matriks dan tidak akan mengalami anneal bahkan dalam kondisi yang kurang ketat.
(c) Basa timin yang berdekatan membentuk dimer TT.
Masalah umum lainnya yang sering terjadi dalam diagnostik molekuler adalah pelepasan asam nukleat target yang kurang optimal dibandingkan dengan ekstraksi fenol-kloroform. Dalam kasus ekstrem, hal ini dapat dikaitkan dengan hasil negatif palsu. Lisis perebusan atau pencernaan enzimatik debris sel dapat menghemat banyak waktu, tetapi metode ini seringkali menghasilkan sensitivitas PCR yang rendah karena pelepasan asam nukleat yang tidak memadai.
Penghambatan aktivitas polimerase selama amplifikasi
Secara umum, inhibisi digunakan sebagai konsep wadah untuk menggambarkan semua faktor yang menyebabkan hasil PCR suboptimal. Dalam pengertian biokimia yang ketat, inhibisi terbatas pada aktivitas enzim, yaitu, inhibisi mengurangi atau mencegah konversi substrat-produk melalui interaksi dengan situs aktif DNA polimerase atau kofaktornya (misalnya, Mg2+ untuk DNA polimerase Taq).
Komponen dalam sampel atau berbagai penyangga dan ekstrak yang mengandung reagen dapat secara langsung menghambat enzim atau menjebak kofaktornya (misalnya EDTA), sehingga menonaktifkan polimerase dan pada gilirannya menyebabkan hasil PCR menurun atau negatif palsu.
Namun, banyak interaksi antara komponen reaksi dan asam nukleat yang mengandung target juga disebut sebagai 'inhibitor PCR'. Setelah integritas sel terganggu oleh isolasi dan asam nukleat dilepaskan, interaksi antara sampel dan larutan serta fase padat di sekitarnya dapat terjadi. Misalnya, 'pemulung' dapat mengikat DNA untai tunggal atau ganda melalui interaksi non-kovalen dan mengganggu isolasi serta pemurnian dengan mengurangi jumlah target yang akhirnya mencapai wadah reaksi PCR.
Secara umum, inhibitor PCR terdapat di sebagian besar cairan tubuh dan reagen yang digunakan untuk uji diagnostik klinis (urea dalam urin, hemoglobin dan heparin dalam darah), suplemen makanan (komponen organik, glikogen, lemak, ion Ca2+) dan komponen di lingkungan (fenol, logam berat).
| Penghambat | Sumber |
| Ion kalsium | Susu, jaringan tulang |
| Kolagen | Jaringan |
| Garam empedu | Kotoran |
| Hemoglobin | Dalam darah |
| Hemoglobin | Sampel darah |
| Asam humat | Tanah, tanaman |
| Darah | Darah |
| Laktoferin | Darah |
| (Eropa) melanin | Kulit, rambut |
| Mioglobin | Jaringan otot |
| Polisakarida | Tanaman, kotoran |
| Protease | Susu |
| Urea | Air seni |
| Mukopolisakarida | Tulang rawan, selaput lendir |
| Lignin, selulosa | Tanaman |
Inhibitor PCR yang lebih umum dapat ditemukan pada bakteri dan sel eukariotik, DNA non-target, makromolekul pengikat DNA pada matriks jaringan, dan peralatan laboratorium seperti sarung tangan dan plastik. Pemurnian asam nukleat selama atau setelah ekstraksi merupakan metode yang lebih disukai untuk menghilangkan inhibitor PCR.
Saat ini, berbagai peralatan ekstraksi otomatis dapat menggantikan banyak protokol manual, tetapi pemulihan dan/atau pemurnian target 100% belum pernah tercapai. Inhibitor potensial mungkin masih terdapat dalam asam nukleat yang dimurnikan atau mungkin sudah aktif. Terdapat berbagai strategi untuk mengurangi dampak inhibitor. Pemilihan polimerase yang tepat dapat berdampak signifikan pada aktivitas inhibitor. Metode lain yang terbukti efektif untuk mengurangi inhibisi PCR adalah dengan meningkatkan konsentrasi polimerase atau menggunakan aditif seperti BSA.
Penghambatan reaksi PCR dapat ditunjukkan dengan penggunaan pengendalian mutu proses internal (IPC).
Semua reagen dan larutan lain dalam kit ekstraksi, seperti etanol, EDTA, CETAB, LiCl, GuSCN, SDS, isopropanol, dan fenol, harus dibersihkan dari isolat asam nukleat melalui proses pencucian menyeluruh. Tergantung pada konsentrasinya, reagen dan larutan tersebut dapat mengaktifkan atau menghambat PCR.
Waktu posting: 19 Mei 2023
 中文网站
中文网站