Baru-baru ini, JAMA Oncology (IF 33.012) menerbitkan hasil penelitian penting [1] oleh tim Prof. Cai Guo-ring dari Rumah Sakit Kanker Universitas Fudan dan Prof. Wang Jing dari Rumah Sakit Renji Sekolah Kedokteran Universitas Shanghai Jiao Tong, bekerja sama dengan KUNYUAN BIOLOGY: “Deteksi Dini Penyakit Residual Molekuler dan Stratifikasi Risiko untuk Kanker Kolorektal Stadium I hingga III melalui Metilasi DNA Tumor yang Bersirkulasi dan Stratifikasi Risiko)”. Studi ini adalah studi multisenter pertama di dunia yang menerapkan teknologi metilasi multigen ctDNA darah berbasis PCR untuk prediksi kekambuhan kanker kolorektal dan pemantauan kekambuhan, menyediakan jalur dan solusi teknis yang lebih hemat biaya dibandingkan dengan metode teknologi deteksi MRD yang ada, yang diharapkan dapat sangat meningkatkan penggunaan klinis prediksi dan pemantauan kekambuhan kanker kolorektal, dan secara signifikan meningkatkan kelangsungan hidup dan kualitas hidup pasien. Studi ini juga dievaluasi secara mendalam oleh jurnal dan editornya, serta terdaftar sebagai makalah rekomendasi utama dalam edisi ini. Profesor Juan Ruiz-Bañobre dari Spanyol dan Profesor Ajay Goel dari Amerika Serikat diundang untuk meninjaunya. Studi ini juga dilaporkan oleh GenomeWeb, media biomedis terkemuka di Amerika Serikat.

Kanker kolorektal (CRC) adalah tumor ganas umum pada saluran pencernaan di Tiongkok. Data Badan Internasional untuk Penelitian Kanker (IARC) tahun 2020 menunjukkan bahwa 555.000 kasus baru di Tiongkok mencakup sekitar 1/3 dari dunia, dengan tingkat kejadian melonjak ke tempat kedua kanker umum di Tiongkok; 286.000 kematian mencakup sekitar 1/3 dari dunia, menempati peringkat sebagai penyebab kematian akibat kanker paling umum kelima di Tiongkok. Penyebab kematian kelima di Tiongkok. Perlu dicatat bahwa di antara pasien yang terdiagnosis, stadium TNM I, II, III dan IV masing-masing adalah 18,6%, 42,5%, 30,7% dan 8,2%. Lebih dari 80% pasien berada pada stadium tengah dan akhir, dan 44% di antaranya memiliki metastasis jauh simultan atau heterokronik ke hati dan paru-paru, yang secara serius mempengaruhi masa bertahan hidup, membahayakan kesehatan penduduk kita dan menyebabkan beban sosial dan ekonomi yang berat. Menurut statistik Pusat Kanker Nasional, rata-rata kenaikan biaya pengobatan kanker kolorektal di Tiongkok per tahun berkisar antara 6,9% hingga 9,2%, dan pengeluaran kesehatan pribadi pasien dalam satu tahun setelah diagnosis dapat mencapai 60% dari pendapatan keluarga. Pasien kanker menderita penyakit ini dan juga berada di bawah tekanan ekonomi yang besar [2].
Sembilan puluh persen lesi kanker kolorektal dapat diangkat melalui pembedahan, dan semakin dini tumor terdeteksi, semakin tinggi tingkat kesintasan lima tahun setelah reseksi bedah radikal, tetapi tingkat kekambuhan keseluruhan setelah reseksi radikal masih sekitar 30%. Tingkat kesintasan lima tahun kanker kolorektal pada populasi Tiongkok adalah 90,1%, 72,6%, 53,8%, dan 10,4% untuk stadium I, II, III, dan IV, masing-masing.
Penyakit residu minimal (MRD) merupakan penyebab utama kekambuhan tumor setelah pengobatan radikal. Dalam beberapa tahun terakhir, teknologi deteksi MRD untuk tumor padat telah berkembang pesat, dan beberapa studi observasional dan intervensional yang komprehensif telah mengonfirmasi bahwa status MRD pascaoperasi dapat mengindikasikan risiko kekambuhan kanker kolorektal pascaoperasi. Pengujian ctDNA memiliki keunggulan noninvasif, sederhana, cepat, dengan aksesibilitas sampel yang tinggi, dan mengatasi heterogenitas tumor.
Pedoman NCCN AS untuk kanker kolon dan pedoman CSCO Tiongkok untuk kanker kolorektal menyatakan bahwa untuk penentuan risiko kekambuhan pascaoperasi dan pemilihan kemoterapi adjuvan pada kanker kolon, pengujian ctDNA dapat memberikan informasi prognostik dan prediktif untuk membantu pengambilan keputusan pengobatan adjuvan bagi pasien kanker kolon stadium II atau III. Namun, sebagian besar penelitian yang ada berfokus pada mutasi ctDNA berdasarkan teknologi sekuensing throughput tinggi (NGS), yang memiliki proses kompleks, waktu tunggu yang lama, dan biaya tinggi [3], dengan sedikit keterbatasan generalisasi dan prevalensi yang rendah di antara pasien kanker.
Untuk pasien kanker kolorektal stadium III, pemantauan dinamis ctDNA berbasis NGS membutuhkan biaya hingga $10.000 untuk satu kali kunjungan dan memerlukan masa tunggu hingga dua minggu. Dengan uji metilasi multigen dalam studi ini, ColonAiQ®, pasien dapat menjalani pemantauan ctDNA dinamis dengan biaya sepersepuluh lebih rendah dan mendapatkan laporan hanya dalam dua hari.
Menurut 560.000 kasus baru kanker kolorektal di Tiongkok setiap tahun, pasien klinis terutama dengan kanker kolorektal stadium II-III (proporsinya sekitar 70%) memiliki permintaan yang lebih mendesak untuk pemantauan dinamis, maka ukuran pasar pemantauan dinamis MRD kanker kolorektal mencapai jutaan orang setiap tahun.
Terlihat bahwa hasil penelitian ini memiliki signifikansi ilmiah dan praktis yang penting. Melalui studi klinis prospektif skala besar, telah dikonfirmasi bahwa teknologi metilasi multigen ctDNA darah berbasis PCR dapat digunakan untuk prediksi dan pemantauan kekambuhan kanker kolorektal dengan sensitivitas, ketepatan waktu, dan efektivitas biaya yang lebih baik, sehingga memungkinkan pengobatan presisi untuk memberikan manfaat yang lebih besar bagi lebih banyak pasien kanker. Studi ini didasarkan pada ColonAiQ®, sebuah uji metilasi multigen untuk kanker kolorektal yang dikembangkan oleh KUNY, yang nilai aplikasi klinisnya dalam skrining dan diagnosis dini telah dikonfirmasi oleh sebuah studi klinis pusat.
Gastroenterologi (IF33.88), jurnal internasional terkemuka di bidang penyakit gastrointestinal pada tahun 2021, melaporkan hasil penelitian multisenter dari Rumah Sakit Zhongshan Universitas Fudan, Rumah Sakit Kanker Universitas Fudan, dan lembaga medis terkemuka lainnya bersama dengan KUNYAN Biological, yang mengonfirmasi kinerja luar biasa ColonAiQ® ChangAiQ® dalam skrining dini dan diagnosis dini kanker kolorektal, dan awalnya mengeksplorasi Ini juga mengeksplorasi potensi aplikasi dalam pemantauan prognosis kanker kolorektal.
Untuk lebih memvalidasi penerapan klinis metilasi ctDNA dalam stratifikasi risiko, memandu keputusan perawatan dan pemantauan kekambuhan dini pada kanker kolorektal stadium I-III, tim peneliti mengikutsertakan 299 pasien dengan kanker kolorektal stadium I-III yang menjalani operasi radikal dan mengumpulkan sampel darah di setiap titik tindak lanjut (tiga bulan terpisah) dalam waktu satu minggu sebelum operasi, satu bulan setelah operasi, dan dalam terapi adjuvan pascaoperasi untuk pengujian ctDNA darah dinamis.
Pertama, ditemukan bahwa pengujian ctDNA dapat memprediksi risiko kekambuhan pada pasien kanker kolorektal secara dini, baik sebelum operasi maupun awal setelah operasi. Pasien ctDNA positif pra operasi memiliki probabilitas kekambuhan pasca operasi yang lebih tinggi daripada pasien ctDNA negatif pra operasi (22,0% > 4,7%). Pengujian ctDNA pasca operasi dini masih memprediksi risiko kekambuhan: satu bulan setelah reseksi radikal, pasien ctDNA positif 17,5 kali lebih mungkin untuk kambuh daripada pasien negatif; tim juga menemukan bahwa pengujian ctDNA dan CEA gabungan sedikit meningkatkan kinerja dalam mendeteksi kekambuhan (AUC = 0,849), tetapi perbedaannya tidak signifikan dibandingkan dengan pengujian ctDNA (AUC = 0,839) saja. Perbedaannya tidak signifikan dibandingkan dengan ctDNA saja (AUC = 0,839).
Stadium klinis dikombinasikan dengan faktor risiko saat ini menjadi dasar utama untuk stratifikasi risiko pasien kanker, dan dalam paradigma saat ini, sejumlah besar pasien masih kambuh [4], dan ada kebutuhan mendesak untuk alat stratifikasi yang lebih baik karena pengobatan berlebih dan pengobatan kurang hidup berdampingan di klinik. Berdasarkan hal ini, tim mengklasifikasikan pasien dengan kanker kolorektal stadium III ke dalam beberapa subkelompok berdasarkan penilaian risiko kekambuhan klinis (risiko tinggi (T4/N2) dan risiko rendah (T1-3N1)) dan periode pengobatan adjuvan (3/6 bulan). Analisis menemukan bahwa pasien dalam subkelompok risiko tinggi pasien ctDNA-positif memiliki tingkat kekambuhan yang lebih rendah jika mereka menerima terapi adjuvan selama enam bulan; pada subkelompok risiko rendah pasien ctDNA-positif, tidak ada perbedaan signifikan antara siklus pengobatan adjuvan dan hasil pasien; sementara pasien ctDNA-negatif memiliki prognosis yang jauh lebih baik daripada pasien ctDNA-positif dan periode bebas kekambuhan pascaoperasi (RFS) yang lebih lama; kanker kolorektal stadium I dan stadium II risiko rendah Semua pasien ctDNA-negatif tidak mengalami kekambuhan dalam dua tahun; oleh karena itu, integrasi ctDNA dengan fitur klinis diharapkan dapat lebih mengoptimalkan stratifikasi risiko dan memprediksi kekambuhan dengan lebih baik.
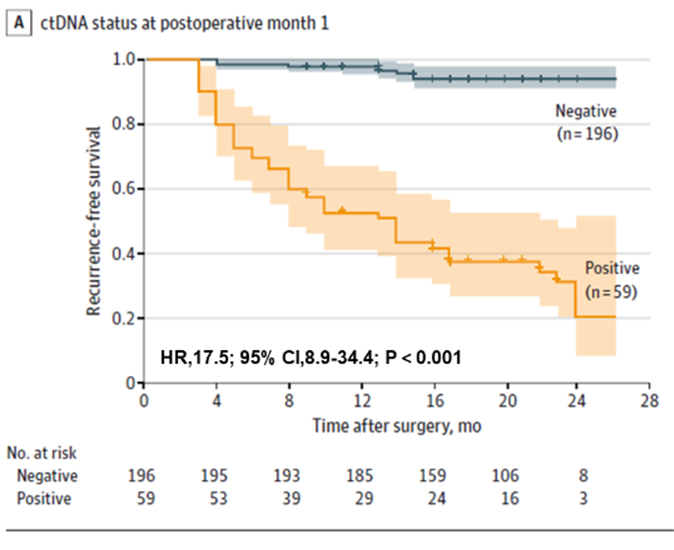
Gambar 1. Analisis ctDNA plasma pada POM1 untuk deteksi dini kekambuhan kanker kolorektal
Hasil lebih lanjut dari pengujian ctDNA dinamis menunjukkan bahwa risiko kekambuhan secara signifikan lebih tinggi pada pasien dengan pengujian ctDNA dinamis positif dibandingkan pada pasien dengan ctDNA negatif selama fase pemantauan kekambuhan penyakit setelah perawatan definitif (setelah operasi radikal + terapi adjuvan) (Gambar 3ACD), dan bahwa ctDNA dapat mengindikasikan kekambuhan tumor hingga 20 bulan lebih awal daripada pencitraan (Gambar 3B), menawarkan kemungkinan deteksi dini kekambuhan penyakit dan intervensi tepat waktu.
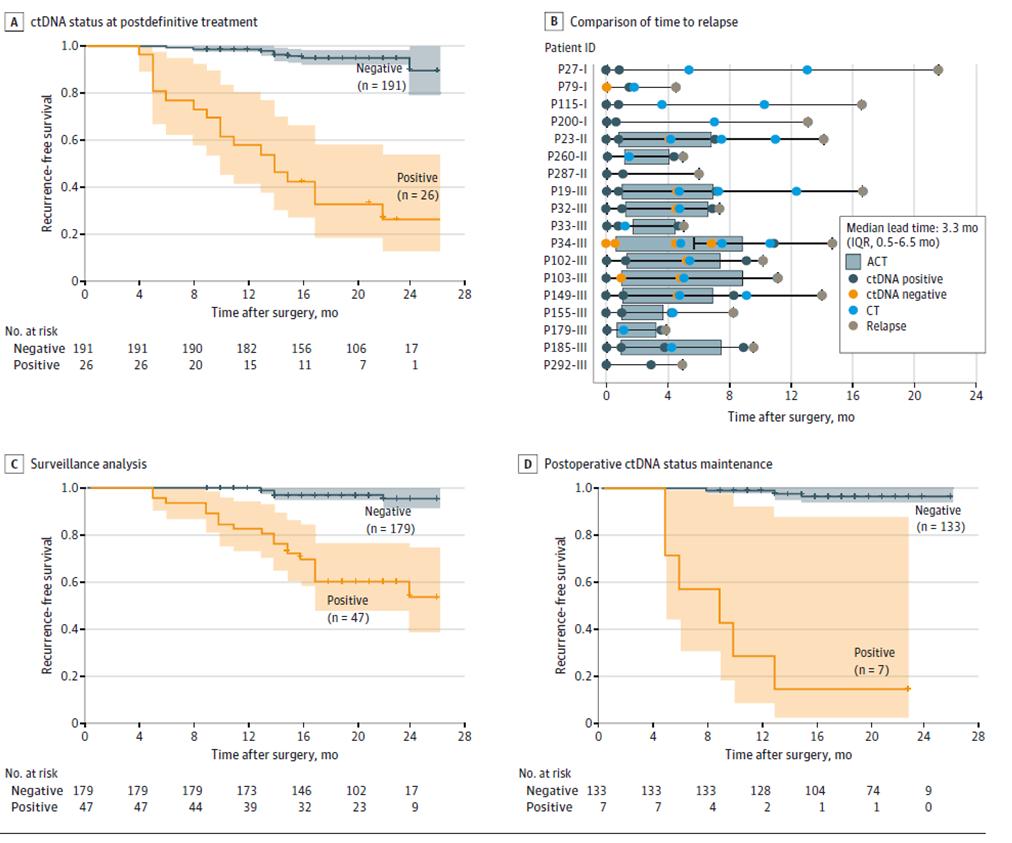
Gambar 2. Analisis ctDNA berdasarkan kohort longitudinal untuk mendeteksi kekambuhan kanker kolorektal
“Sejumlah besar studi kedokteran translasi dalam kanker kolorektal menjadi yang terdepan dalam disiplin ini, terutama pengujian MRD berbasis ctDNA yang menunjukkan potensi besar untuk meningkatkan manajemen pascaoperasi pasien kanker kolorektal dengan memungkinkan stratifikasi risiko kekambuhan, memandu keputusan pengobatan, dan memantau kekambuhan dini.
Keuntungan memilih metilasi DNA sebagai penanda MRD baru daripada deteksi mutasi adalah karena hal itu tidak memerlukan penyaringan pengurutan genom keseluruhan jaringan tumor, langsung digunakan untuk pengujian darah, dan menghindari hasil positif palsu karena mendeteksi mutasi somatik yang berasal dari jaringan normal, penyakit jinak, dan hematopoiesis klonal.
Studi ini dan studi terkait lainnya mengonfirmasi bahwa pengujian MRD berbasis ctDNA merupakan faktor risiko independen terpenting untuk kekambuhan kanker kolorektal stadium I-III dan dapat digunakan untuk membantu memandu keputusan pengobatan, termasuk "eskalasi" dan "penurunan" terapi adjuvan. MRD merupakan faktor risiko independen terpenting untuk kekambuhan setelah operasi kanker kolorektal stadium I-III.
Bidang MRD berkembang pesat dengan sejumlah uji inovatif, sangat sensitif, dan spesifik berbasis epigenetika (metilasi DNA dan fragmentomik) dan genomik (pengurutan tertarget ultra-dalam atau pengurutan genom utuh). Kami berharap ColonAiQ® terus menyelenggarakan studi klinis skala besar dan dapat menjadi indikator baru pengujian MRD yang menggabungkan aksesibilitas, kinerja tinggi, dan keterjangkauan, serta dapat digunakan secara luas dalam praktik klinis rutin.
Referensi
[1] Mo S, Ye L, Wang D, Han L, Zhou S, Wang H, Dai W, Wang Y, Luo W, Wang R, Xu Y, Cai S, Liu R, Wang Z, Cai G. Deteksi Dini Penyakit Residu Molekuler dan Stratifikasi Risiko untuk Kanker Kolorektal Stadium I hingga III melalui Metilasi DNA Tumor yang Bersirkulasi. JAMA Oncol. 20 April 2023.
[2] “Beban penyakit kanker kolorektal pada populasi Tiongkok: apakah sudah berubah dalam beberapa tahun terakhir? , Jurnal Epidemiologi Tiongkok, Vol. 41, No. 10, Oktober 2020.
[3] Tarazona N, Gimeno-Valiente F, Gambardella V, dkk. Pengurutan DNA tumor sirkulasi generasi berikutnya yang ditargetkan untuk melacak penyakit residu minimal pada kanker usus besar terlokalisasi. Ann Oncol. 1 November 2019;30(11):1804-1812.
[4] Taieb J, André T, Auclin E. Penyempurnaan terapi adjuvan untuk kanker usus besar non-metastatik, standar dan perspektif baru. Cancer Treat Rev. 2019;75:1-11.
Waktu posting: 28-Apr-2023
 中文网站
中文网站